
Robert Wild und seine Versuchsapparatur ©Simon Schöpf
Von Simon Schöpf
Lesezeit: ca. 6 Minuten
Lange Zeit wurde davon ausgegangen, dass chemische Reaktionen im Weltraum so gut wie unmöglich sind. Es wäre zu kalt und die Teilchendichte zu gering damit sich Moleküle bilden können. Postdoc Dr. Robert Wild von der Arbeitsgruppe Molekulare Systeme im Institut für Ionenphysik und Angewandte Physik forscht jedoch genau an solchen Reaktionen – im „simulierten“ Weltraum in seinem Labor.
Chemie im Weltraum
Im Weltraum gibt es große Molekülwolken, die durch die Schwerkraft irgendwann zusammenfallen und dabei Sterne und Planeten formen – so entstand auch unser Sonnensystem. Was für chemische Prozesse in diesen Molekülwolken passieren, davon weiß man bisher aber nicht viel.
Robert Wild und sein Team stellen die Bedingungen des Weltraums nach, um herauszufinden, was da eigentlich passiert. Es stellte sich heraus, dass die chemischen Prozesse hauptsächlich durch geladene Teilchen, sogenannte Ionen, passieren.
Chemische Reaktionen auf der Erde funktionieren meist dadurch, dass mit Hilfe von Energie eine Reaktion ausgelöst wird. Mit einem Feuerzeug wird ein Funken erzeugt, dieser liefert die erforderliche Aktivierungsenergie, um das Luft-Gas-Gemisch zu entzünden. Im Weltraum gibt es diesen „Funken“ aber nicht, da es so kalt ist. Ohne Funken, keine chemische Reaktion hatte man gedacht.
Die Ionen können nun aber positiv oder negativ geladen sein und so andere Teilchen anziehen, ähnlich einem Magneten. Diese geringe Energie reicht aus, um eine chemische Reaktion auszulösen.

Elektroden im Vakuum, die die geladenen Teilchen in Richtung Ionenfalle beschleunigen. Durch das TOF Verfahren, können dann auch verschiedene Massen zum Fangen ausgewählt werden ©Simon Schöpf
Sehr, sehr kalt…
Die Temperaturskala die Physiker*innen hierzu heranziehen ist Kelvin. Der absolute Nullpunkt ist 0 Kelvin. Das entspricht -273,15° Celsius – bei dieser Temperatur würden Atome oder Moleküle sich nicht mehr bewegen (vgl. dazu unseren Artikel über Experimentalphysik). In den Molekülwolken herrscht eine Temperatur von zehn bis 100 Kelvin. Zum Vergleich: flüssiger Stickstoff, der u. a. zum Schockgefrieren verwendet wird, hat eine Temperatur von 77 Kelvin. Chemische Reaktionen mit neutralen Atomen oder Molekülen findet bei solch niedrigen Temperaturen so gut wie nicht statt.
Molekülwolken im Weltraum

Apparatur, um die chemischen Reaktionen im Weltall nachzustellen und anschließen zu messen ©Simon Schöpf
Die Molekülwolken können gigantische Ausmaße von vielen Lichtjahren annehmen. Diese haben auch unterschiedliche Eigenschaften, sind z. B. kälter oder heißer. Was am häufigsten gefunden wird ist Wasserstoff. Das kleinste Element ist gleichzeitig auch das häufigste im ganzen Universum, gefolgt vom Helium, dem zweihäufigsten Element. Helium ist ein Edelgas und reagiert dementsprechend wenig mit anderen Elementen.
Darüber hinaus finden sich Kohlenstoff, Stickstoff und Sauerstoff. Andere Elemente werden dann immer seltener. Da Wasserstoff am häufigsten ist, finden die meisten Stöße zwischen verschiedenen Wasserstoffen bzw. Wasserstoff mit den erwähnten Elementen statt. Wenn wir auf der Erde von Wasserstoff sprechen, dann ist meist das Molekül H2 gemeint, also zwei Wasserstoffe, die sich ein Elektronenpaar teilen. Im Weltraum findet sich aber viel atomarer Wasserstoff H. Hier liegt der Fokus von Robert Wilds Forschung: Wie reagiert der Wasserstoff im Labor? Ziel ist es Vorhersagen zu treffen und Modelle zu erschaffen, wie diese Wasserstoffreaktionen funktionieren.
Wie kommt das Weltall ins Labor?

Die Ionenfalle. Der „Käfig“ besteht aus 16 Kupferdrähten, jeweils mit 100 Mikrometer Durchmesser. Der Durchmesser des Käfigs ist ungefähr einen Centimeter. ©Robert Wild
Das schwierige an der Forschung ist die Eigenschaft des Wasserstoffs auf der Erde. Dieser will nicht „alleine“ bleiben und verbindet sich mit anderen Wasserstoffen, oder anderen Elementen. Also müssen sich die Wissenschaftler*innen etwas einfallen lassen.
Als erstes müssen Ionen erzeugt werden, das geschieht mit einem Plasma. Da Ionen geladen sind, können sie durch ein elektrisches Feld leicht beeinflusst werden – negative Ionen (Anionen) werden vom Pluspol angezogen, positive Ionen (Kationen) vom Minuspol. So werden die Ionen in eine Ionenfalle geschickt und mit Hilfe von Helium abgekühlt. Das funktioniert, stark vereinfacht, durch Stöße mit dem Helium. Wärme ist die Bewegung der Teilchen, sobald die Teilchen mit dem Helium zusammenstoßen, werden sie gebremst und werden so kälter.

Sichtfenster ermöglicht den Einblick in die Apparatur ©Simon Schöpf
Konkret werden bei einem der Experimente von Robert Wild Cyanid-Anionen (CN– Ionen) erzeugt. Dann werden Wasserstoffatome auf Kollisionskurs mit den CN–-Ionen geschickt. Wenn diese kollidieren können sie miteinander reagieren: Ein HCN und ein freies Elektron entsteht (oder eben nicht). Da HCN nicht geladen ist, geht es aus der Falle verloren, und dieser Verlust gilt als Nachweis der Reaktion.
Bei einem anderen Experiment reagierten Chlor Anionen (Cl–) mit Wasserstoff. Dabei bildete sich ClH2–. Um nachzuweisen, ob nun das vorhergesagte Molekül entstanden ist, braucht es einen sogenannten Flugzeitmassenspektrometer (TOF-MS). Massenspektrometer messen die Ladung und Masse von Atomen und Molekülen (vgl. dazu unseren Artikel mit dem Rüssel für das MS).
„Flugzeitmassenspektrometer ist ein tolles Wort, was nicht mehr bedeutet als: Man schubst alle Sachen gleich stark und die leichteren fliegen schneller“, hält der Robert Wild lachend fest.
Der Forscher erklärt es aber auch genauer. Die Ionenfalle wird geöffnet und mit einem elektrischen Stoß werden die Ionen aus der Falle hinausbefördert. Sie fliegen dann lange genug, damit sich die leichteren und schwereren voneinander trennen können. Die leichteren eilen voraus und sobald sie auf den Detektor treffen, gibt dieser ein Signal. Die schwereren Cl–H2 Moleküle brauchen länger und werden dementsprechend erst später detektiert.
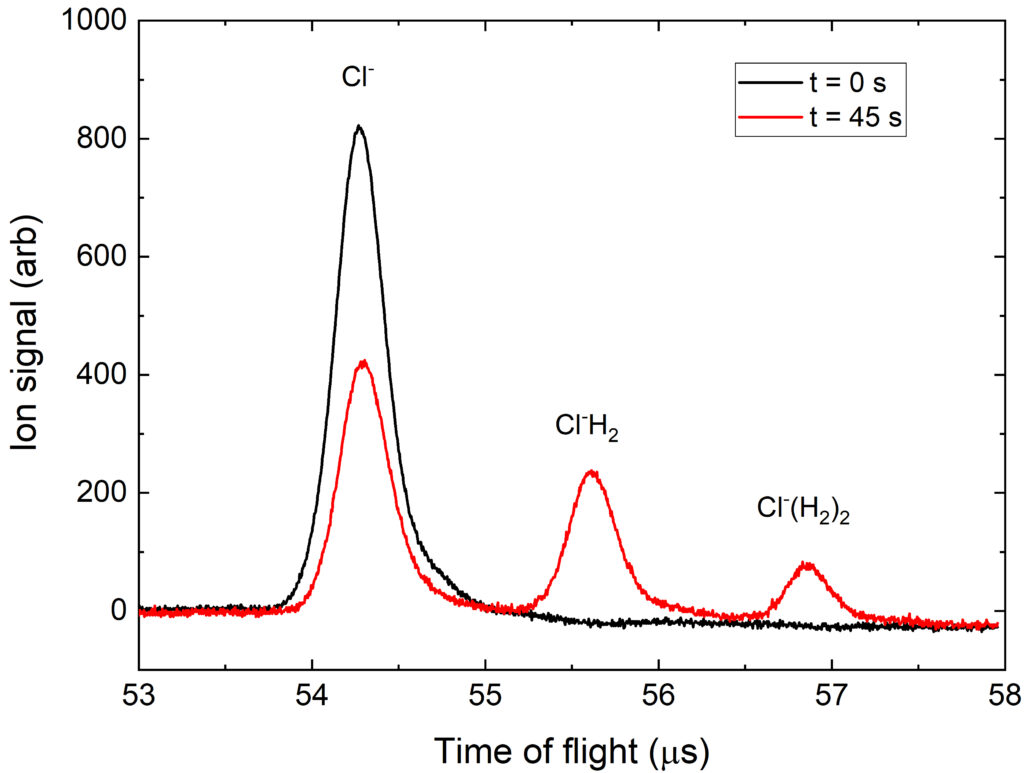
Ein Massenspektrum von Cl–. Zu sehen sind zwei übereinandergelegte Spektren. In Schwarz ist die Reaktionszeit null, also keine Zeit zum Reagieren. Es ist nur das Cl– zu sehen. In Rot ist das Spektrum mit 45 Sekunden Reaktionszeit. Es gibt weniger Cl– und mehr Cl–H2. Cl–H2 kann auch weiterreagieren, was am letzten Peak gesehen werden kann, aber das liegt nicht im Fokus der aktuellen Forschungsfrage ©Robert Wild
Wie findet man die Moleküle eigentlich?
Spannend ist hierbei auch, wie die Atome und Moleküle im Weltall überhaupt entdeckt werden. Dazu müssen die „spektralen Fingerabdrücke“ gefunden werden. Wenn sich ein Stern hinter einer Molekülwolke befindet, sendet dieser Licht aus – vergleichbar mit einem Regenbogen. Die Moleküle nehmen dieses Licht auf (absorbieren die Energie) und zwar jedes Element bzw. Molekül nimmt eine spezifische Energie auf. Wenn das Licht dann auf der Erde ankommt, oder einem Weltraumteleskop, ist es nicht mehr der ganze „Regenbogen“, sondern es fehlen ein paar Farben (bestimmte Wellenlängen werden absorbiert). Daraus kann dann geschlossen werden, was sich in der Wolke befindet.
Robert Wild dazu: „Warum kann ein Molekül Licht absorbieren: Erstens kann das Licht ein Elektron im Molekül zum Beispiel auf eine höhere Umlaufbahn bringen. Es kann aber auch das Molekül zum Vibrieren oder Rotieren bringen. Wenn es genau resonant ist, wenn also die Wellenlänge genau stimmt, kann es das machen. Dann absorbiert es die Wellenlänge. Wenn die Wellenlänge nicht stimmt, dann ist das Molekül durchsichtig und das Licht fliegt einfach weiter.“
Das Schwierige dabei ist, dass je größer die Moleküle werden, desto komplexer werden die Vibrationen und Rotationen. Dementsprechend schwieriger ist es die „Fingerabdrücke“ überhaupt zu erkennen.
Forschungsziele
Robert Wild und sein Team wollen mit ihren Experimenten die Temperaturabhängigkeit der Reaktionen spezifisch messen, um die Reaktionsgeschwindigkeit bzw. Reaktionswahrscheinlichkeit besser vorhersagen zu können. Reagiert das Atom mit dem anderen, oder stoßen sie sich wieder ab, wenn es kälter wird? Mit was für einer Wahrscheinlichkeit? Die Daten der Experimente helfen dabei Molekülwolken besser zu modellieren und so besser zu verstehen, wie Moleküle im Weltall entstehen bzw. entstehen könnten. Dies führt zu weiteren Fragen: Müssen quantenmechanische Überlegungen hinzugenommen werden? Wie passieren chemische Reaktionen auf diesem quantenmechanischen Level?
„Die Wissenschaft als Ganzes, also alles, was wir nicht wissen oder nicht verstehen, finde ich spannend. Sachen zu erforschen und Dinge rauszufinden, die noch niemand kennt; die offenen Fragen für die Menschheit, die (noch) niemand versteht… sich da hineinzuvertiefen, um das rauszufinden, worum es eigentlich geht […] das ist ganz cool, das ist ganz spannend. Also darum geht es mir“, schließt Robert Wild unser Interview.
Homepage:
https://www.uibk.ac.at/ionen-angewandte-physik/molsyst/
LinkedIn Profil:
https://www.linkedin.com/in/robertwild8/?originalSubdomain=at
